查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





“放疗专栏”由《中国医学论坛报》联合中华放射肿瘤学会(CSTRO)推出,以CSTRO平台为依托,邀请国内外放疗领域的专家学者,分瘤种介绍肿瘤放射治疗的进展、共识规范以及临床实践中的困惑和难点解析,力求为广大临床医生们提供最“接地气”的内容。
脑胶质瘤是一种常见的原发颅内肿瘤,大致可分为高级别胶质瘤和低级别胶质瘤两种,预后及治疗原则不同。现将近年来脑胶质瘤放疗相关规范进行总结和介绍。
临床特征与诊断
高级别脑胶质瘤主要包括胶质母细胞瘤、间变型星形细胞瘤、间变少突细胞瘤和间变少突星形细胞瘤,其中75%为多形性胶质母细胞瘤。其发病率随年龄的增长而递增,45~55岁达到发病高峰。临床表现与肿瘤累及的功能区相关,包括头痛、肢体无力、麻木、失明、言语不能、情绪障碍及记忆障碍等,<25%的患者可出现癫痫。
磁共振成像(MRI)是高级别脑胶质瘤最佳的影像诊断工具,其他影像手段可提供的帮助十分有限。胶质母细胞瘤的典型影像学特征为:浸润性、不均匀的环形强化,伴中央坏死及瘤周水肿,常累及脑白质及胼胝体。尽管强化区域通常不是多灶的,但强化及周围坏死区域常有卫星病灶。IDH基因突变的高级别胶质瘤通常占新诊断病例的5%,影像特征不同,表现为不强化的大块肿瘤,有皮质浸润,水肿与坏死不明显,多发于额叶及颞叶。功能MRI包括弥散相、灌注相以及正电子发射体层摄影(PET)/CT作用不明确,某些报道提示有好处。
术后放疗指征及变迁
脑胶质瘤的切除范围受解剖部位及功能区关系的限制,且肿瘤具有浸润性,通常很难达到真正的完整切除。只有当肿瘤限制在脑功能的“哑区”或主要侵犯颅盖部脑膜和颅骨时,才有可能行根治手术。单纯手术切除后患者中位生存期为3~6个月。目前没有随机对照研究直接比较不同手术范围患者的预后,但已有的回顾性分析结果多显示切除范围与预后呈正相关。术后72小时内需要复查MRI,评估肿瘤的切除范围。高级别恶性胶质瘤T1WI序列增强扫描是诊断的金标准。
针对残存肿瘤及周围亚临床病灶的放疗可改善患者的局控率及总生存(OS)率。20世纪70年代有三项随机对照研究证明了辅助放疗的有效性,将患者的中位生存期由3~6个月延长到了9~12个月,且显著优于辅助化疗。这些研究奠定了高级别胶质细胞瘤术后放疗的地位,当时采用的方案是全脑放疗。
回顾性分析研究结果显示,术后全脑放疗50~60 Gy的患者生存显著优于更低剂量照射的患者,中位生存期分别为19周和11周。1979年发表在“红皮杂志”《国际放射肿瘤生物物理杂志》(Int J Radiat Oncol Biol Phys)的一项研究表明,放疗剂量60 Gy较50 Gy者生存更佳。随后的两项随机对照研究显示,全脑放疗60 Gy再局部推量10 Gy并未得到进一步的局控或生存获益,因此目前普遍采用的处方剂量是60 Gy。
然而全脑放疗毒性极大,患者放疗后出现脑损伤概率很高,极大地影响了患者的生活质量。在对接受全脑放疗患者的随访及尸检中发现,80%~90%患者的复发出现在瘤周2 cm内,仅不到10%的患者为多灶病灶。因此目前不再建议行全脑放疗,局部扩大野照射成为标准方案。靶区大多建议至少包全肿瘤(瘤床)及瘤周2 cm范围,一般为2~3 cm,不必包括整个水肿带,并根据解剖边界修正(颅骨0 mm,脑室5 mm,大脑镰5 mm,小脑幕5 mm,视通路、视交叉、脑干0 mm)。
在局部扩大野照射时代的荟萃分析显示,肿瘤45~62 Gy之间存在剂量效应关系,MRC BR2研究显示60 Gy组生存显著优于45 Gy组,1年OS率分别为39%和29%,中位生存期延长了3个月。RTOG及ECOG研究显示70 Gy较60 Gy无生存获益,有效剂量提高的大分割方案及立体定向外科推量也未能改善生存,因此目前的标准照射剂量仍为60 Gy/30 F,超分割方案没有优势。
常用的实际靶区原则及示例
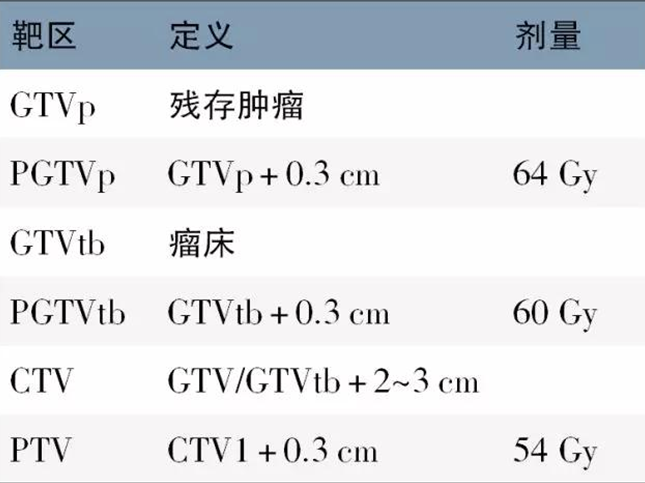
注:GTV,肿瘤靶区;PGTV,计划肿瘤靶区;CTV,临床靶区;PTV,计划靶区。
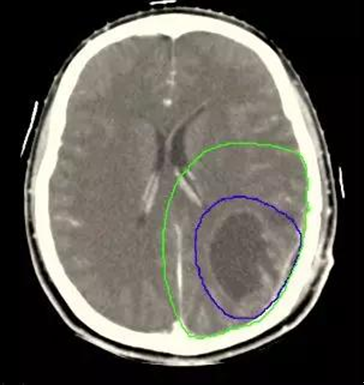
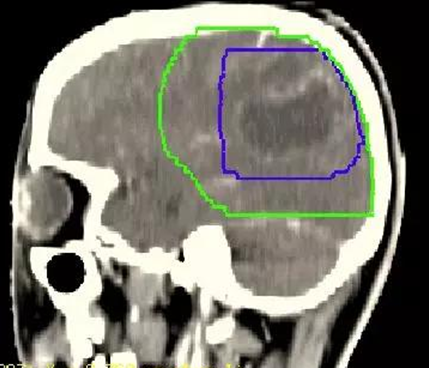
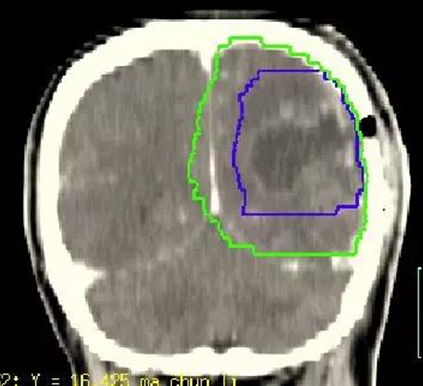
图1 高级别脑胶质瘤靶区勾画(蓝线:GTV,绿线:CTV)
术后同步放化疗
替莫唑胺(TMZ)是一种烷化剂类抗肿瘤药物,本身没有活性,属于前体药物,需要在生理水平pH值下转化为活性化合物5-(3-甲基三氮烯-1-基)咪唑-4-酰胺(MITC),后者进一步水解成活性代谢物方能发挥作用。MTIC主要通过与鸟嘌呤的第六位氧原子产生主要的DNA烷基化(甲基化)作用,同时与第七位氮原子发生次要的附加性烷基化作用而产生细胞毒性。放疗同步+辅助TMZ的治疗是目前70岁以下、一般状态良好、神经精神状态良好的成人初诊恶性胶质瘤的标准治疗方案。该药是目前唯一一个被证实的加入放疗中可显著改善生存的药物。
E O R T C 2 6 9 8 1-22981、NCIC CTG CE.3研究确立了术后放疗同步TMZ的标准治疗地位。研究比较了TMZ同步放化疗+TMZ辅助化疗对比单纯手术的结果,显示中位生存期延长了2.5个月,2年及5年OS率分别提高了16%和8%,风险比(HR)为0.64。TMZ的疗效受患者O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)启动子甲基化状态的影响。MGMT是一种DNA修复酶,其作用是将甲基团从鸟嘌呤的O6位置上移除,从而使细胞避免凋亡。在这过程中,MGMT启动子自身会发生不可逆转的甲基化而被消耗掉,必须重新生成。MGMT甲基化状态是一个预后因素,与MGMT启动子非甲基化的患者相比,甲基化患者总的中位生存期延长(12.2个月对18.2个月,P<0.001)。同时甲基化状态也是疗效预测因素,MGMT启动子甲基化患者,TMZ加入放疗可显著延长中位生存期(21.7个月对15.7个月,P=0.007);而MGMT启动子非甲基化的患者,放疗联合TMZ治疗和单纯放疗相比,中位生存期的差异没有统计学意义(12.7个月对11.8个月)。
对于减瘤术后或者活检术后的患者,AVAglio研究显示在TMZ的基础上加用贝伐珠单抗可进一步提高无进展生存(PFS),中位PFS期从6.2个月延长至10.6个月,可作为临床的一种选择方案。
高龄患者
高龄一直以来被认为是高级别胶质瘤最重要的不良预后因素之一,治疗时需要更多地考虑患者的一般状况及治疗对生活质量的影响。法国的研究显示50.4 Gy的照射相较于最佳支持治疗,可将中位生存期从16.9周提高到29.1周。另外一些小的随机对照研究及亚组分析提示,短程降量的放疗可取得不劣于常规剂量的疗效,且TMZ的加入同样可以进一步提高生存,在MGMT启动子甲基化的患者中获益更多。对于不能耐受同步放化疗的MGMT启动子甲基化的患者,单药TMZ也是选择之一,疗效优于单纯放疗。但根据德国神经肿瘤协作组的结果,在MGMT启动子非甲基化的患者中,单药TMZ疗效劣于放疗,且与单纯放疗相比,TMZ具有更高的胃肠道毒性及血液学毒性。对于一般状况较差的老年患者,小的随机对照研究显示1周的短程放疗与3周的放疗间无生存差异,6周的常规分割放疗也并不优于3周大分割放疗,大分割放疗有更少的激素依赖。因此,对于老年患者的治疗应尽量简化,以改善生活质量、减少住院时间为主。
作者 | 赵婷 李高峰(北京医院)
查看更多