查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





撰文|齐疆
审校|北京协和医院 赵维纲教授
胰岛素是由胰脏内的胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一种蛋白质激素,是机体内唯一降低血糖的激素,同时促进糖原、脂肪、蛋白质合成。
胰岛素作为生物制品,结构复杂,质量标准远高于普通化学药。经由特殊的生产工艺制造;并采用医疗器械注射方式给药,是典型的高生产成本、高风险产品。依据中国药学会医院药学专业委员会用药安全专家组发布的《中国高警示药品推荐目录2019版》,皮下注射胰岛素被列入了35种警示药物。
随着我国糖尿病患者人数增加,胰岛素的临床应用和科学替代引发关注。本文将从胰岛素的临床应用与迭代、临床替代、不良反应监测与评价三方面论述胰岛素制剂临床应用的现状与挑战。
在临床上,胰岛素治疗是控制高血糖的重要手段。
临床应用场景
1型糖尿病患者在发病时就需要胰岛素治疗,且终身需要胰岛素替代治疗来控制高血糖。2型糖尿病患者虽不需要胰岛素来维持生命,但当口服降糖药效果不佳、耐药或存在口服药使用禁忌时,需使用胰岛素控制高血糖,以减少糖尿病并发症的发生危险。在某些时候,尤其是病程较长时,胰岛素治疗可能时最主要的、甚至必需的控制血糖措施。
用药方案个体化
不同的糖尿病患者,1型、2型、妊娠糖尿病等用药方案存在差异。同时,不同胰岛素产品的剂量与给药时间都有明显的差异。因此,胰岛素需个体化用药方案,确保精确给药,提高临床效果。
老年患者胰岛β细胞功能、肝肾功能减退,同时并发症患病率较高,需要更加个体化的管理和精细化的用药。
1型儿童青少年糖尿病患者和妊娠合并糖尿病患者,须精细调节给药剂量平衡疗效和不良反应,否则影响血糖控制水平,可致儿童生长发育迟缓,妊娠早期流产及胎儿畸形发生风险明显增加。
患者依从性
部分糖尿病患者需要长期注射治疗胰岛素,患者依从性对疾病治疗转归至关重要。
胰岛素治疗依从性差不仅直接影响血糖控制效果,还会影响患者的预后,增加额外医疗费用,形成糖尿病患者血糖管理不佳的恶性循环。
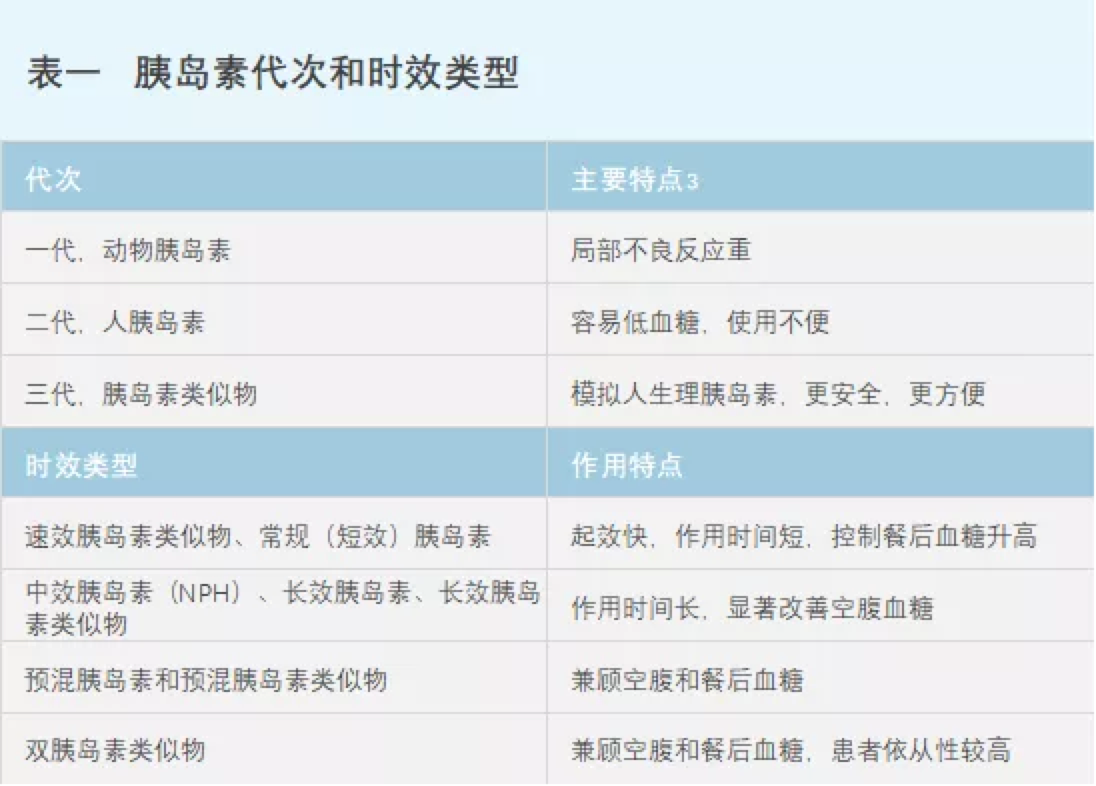
胰岛素制剂产品临床效果的不断优化推动其更新换代。
胰岛素制剂产品临床效果的不断优化是推动其更新换代及时效类型的主要因素之一。
按照来源和结构,胰岛素制剂可分为动物源性胰岛素(第一代)、重组人胰岛素(第二代)和胰岛素类似物(第三代)。大量临床试验证明,第三代胰岛素类似物在模拟生理性胰岛素分泌和减少低血糖发生的风险性方面均优于人胰岛素。而且,胰岛素类似物还给患者的生活带来更大的便利性和灵活性,这也就进一步提高了患者对治疗的依从性。
北京协和医院赵维纲教授表示:“与第二代重组人胰岛素制剂相比,第三代胰岛素类似物在疗效和安全性方面进一步得到提升。具体体现在胰岛素类似物能够更好地模拟人体生理降糖模式,更贴合人体生理需要,血糖控制达标率更高,引起低血糖等不良反应的风险更低。此外,胰岛素类似物还具有注射时间更灵活、更方便等优点。”
临床使用上,不同作用时效类型的胰岛素制剂各具特点,对于胰岛素等生物制剂,由于药品制剂的差异也可能会导致药品在体内的生物学活性和免疫化学特性等的不同,药代动力学/药效动力学(PK/PD)曲线是评估胰岛素作用的基础,医生会根据患者的具体情况,采用不同作用时效类型的胰岛素制定最佳治疗方案。
自20世纪90年代,我国已开始仿制生产人胰岛素制剂。近年来,随着部分原研胰岛素类似物专利到期,很多厂家开始仿制生产原研胰岛素类似物制剂,并陆续上市。目前,我国上市的非原研胰岛素制剂都是按照2007年的《药品注册管理办法》中第15类“已有国家药品标准的生物制品”上市的,并未按照生物类似药的要求申报审批,制剂间的临床替代引发关注。
本部分中的“替代”指胰岛素生物制品和相同通用名不同厂家品牌产品之间的替代(品内替代),不同通用名胰岛素间理论上不是“替代”,为便于阐述,本部分也一并讨论(品间替代)。
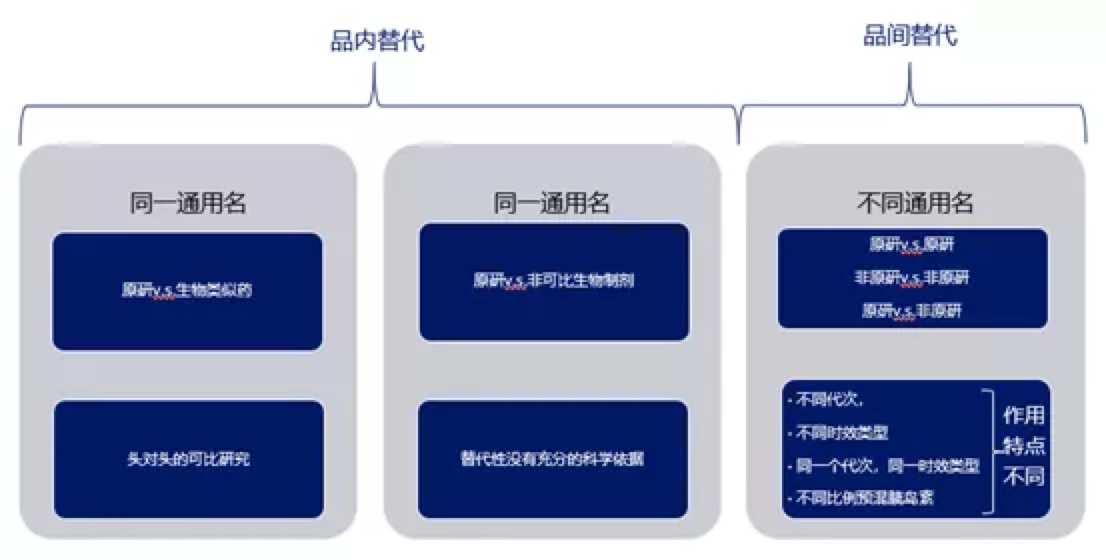
▲品内和品间替代,替代性基于相似性
原研和生物类似药的替代:相似不相同
目前,中国并没有胰岛素生物类似药上市。对于胰岛素生物类似药的开发。由于胰岛素作为治疗型生物制品,与化学药相比,具有相对分子量大、结构复杂的特点,其临床有效性、安全性在很大程度上会受到基因构建、蛋白修饰、生产工艺等复杂因素的影响。
现代工艺下的胰岛素生产经历建库,细胞扩增和发酵、分离、纯化等多个步骤和工序。生物类似药企业一般无法获得原研药的核心技术、关键控制点和生产工艺的完整信息,比如重组制品的种子细胞和培养条件。与原研不同的种子细胞和生产工艺,意味着胰岛素生物类似药与原研胰岛素产品将不完全相同。
同时,胰岛素多需要给药系统(如胰岛素注射笔、泵等)。由于患者可能使用不同的给药系统,因此一般认为,生物类似药的给药系统,PK/PD与参比药也应高度相似。
原研和非可比生物制品的替代:相似性需要科学依据
目前我国上市的国产胰岛素都是按照“已有国家药品标准的生物制品(15类)”批准的,无法证明其与原研产品的相似性。
因此,笔者认为,按此批准的非原研胰岛素产品,只能视为“在原研品上市后申报的同类产品”,或“非可比的生物制品”。
药品通用名称是通过一个唯一的、全球通用的、为公众所属的名称,也即非专利名称,对一种药用物质或活性成分的识别。也就是,不同通用名代表了不同的药用物质和活性成分。
不同通用名的胰岛素如果分属于不同代次,那么不同代次胰岛素安全有效性不同,比如一代胰岛素不良反应重,而三代更加安全方便。
不同通用名的胰岛素如果分属于不同时效类型,则PK/PD不同,如短效速效起效快,适合控制餐后血糖,而中长效胰岛素作用时间长,但对餐后血糖控制差。
不同通用名的胰岛素即使是同一个代次,同一时效类型的胰岛素,其起效时间,达峰时间和作用的持续时间都不完全相同。例如,门冬、赖脯和谷赖胰岛素都属于三代胰岛素中的速效胰岛素类似物,而他们的血药浓度达峰时间和持续时间不完全相同。不同比例预混胰岛素的血清胰岛素峰值水平不同,药代动力学曲线也显著不同。
▼常用胰岛素及其作用
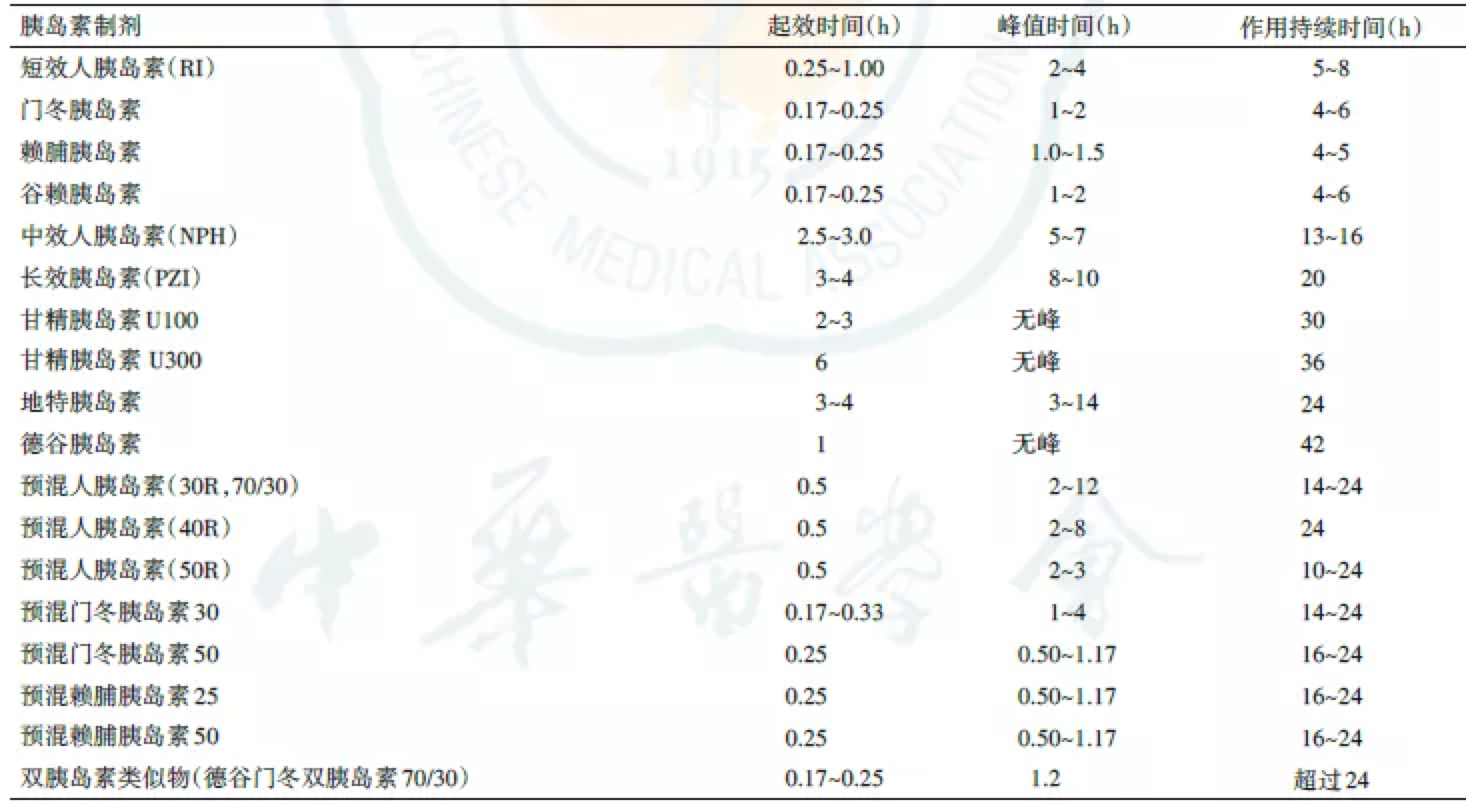
图片来源 | 中国2型糖尿病防治指南(2021年4月发布版)
虽然不同通用名的胰岛素适应证相同,但不同厂家品牌的胰岛素产品对特殊患者的适用条件各不相同,说明书中对特殊患者的安全性和有效性均做说明,如儿童、孕妇等。
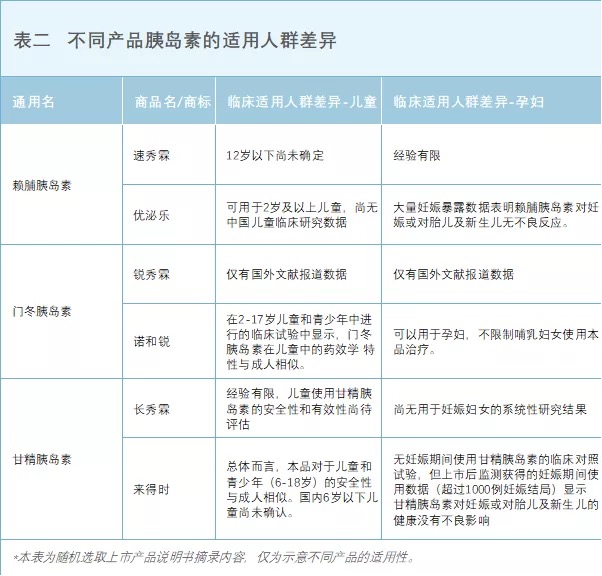
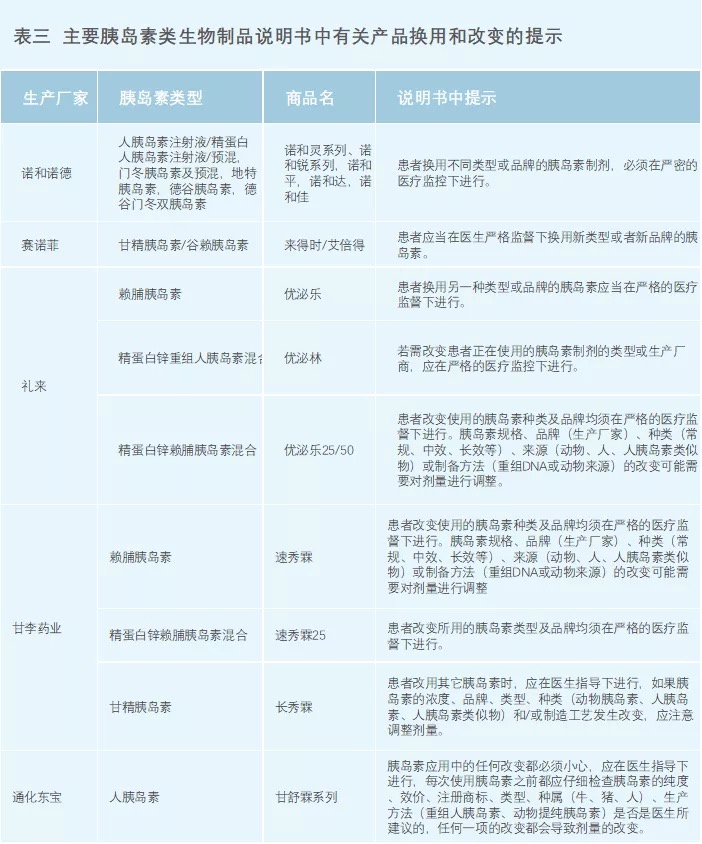
国内所有在售的胰岛素说明书上都提及,不同品牌、厂家之间的胰岛素转换使用,需要严格的医疗监测,应严格按照换药提示进行,如严格的医疗监控,必要的剂量调整等,谨慎替换。
医生和患者在治疗方案的决策过程中应起到核心作用,医生治疗方案的选择必须首先根据临床需要进行判断;处方医生应与患者协商,做出决定。国外调查显示,一半以上的医生认为非医疗原因替换影响安全有效性,患者也存在多方面担心,在此情况下可能影响患者治疗。国内也有调研显示,约有1/4的糖尿病患者不愿被迫替代胰岛素,最主要原因为担心降糖效果。
所以笔者认为,临床替换需要考虑糖尿病患者的具体治疗情况、患者依从性和特殊性带来的潜在用药风险;基于临床治疗需要,给予临床医师选择权和患者知情权;换药的潜在风险应在说明书或标签上有明确警示。如果在临床替换期间发生严重不良事件,可能影响治疗效果,引发患者不满和医疗纠纷等波动。
针对不良反应监测和风险评估,中国近几年陆续出台了政策法规,加强产品安全监管,全面提升药品质量,保障药品安全、有效、质量可控。
胰岛素在其临床应用中,免疫原性一直是重点评估的一项。如果患者机体对胰岛素出现免疫不耐受而产生胰岛素抗体,轻则可能导致疗效降低或丧失,重则将导致不可预知的低血糖发生,甚或出现局部、全身性超敏反应,严重危害患者安全。
赵维纲教授表示:“国外已有非原研胰岛素因无法提供免疫原性数据而上市受阻的先例。”尽管有专家认为“对于胰岛素的不良反应不必过度担忧,整体来看严重的不良事件发生率并不高”,但是建立关于胰岛素的合理的上市后安全性评价系统是业内专家的共识。
胰岛素的治疗窗口狭窄,需要精确的剂量以确保疗效和安全之间达到最佳平衡。
由于目前我国胰岛素生物制品,尚未有按照生物类似药路径批准上市的非原研产品,因此笔者认为,其临床替代应基于科学、循证的原则进行合理选用,结合患者个体化需求,由医师针对患者的具体情况决定治疗方案。
查看更多